Introduzione del fluoruro di magnesio MgF2
Il fluoruro di magnesio è un composto inorganico con la formula MgF2. Il composto è un sale cristallino bianco ed è trasparente su un'ampia gamma di lunghezze d'onda, con usi commerciali nell'ottica che vengono utilizzati anche nei telescopi spaziali.
Il magnesio (simbolo atomico: Mg, numero atomico: 12) è un elemento del Blocco S, Gruppo 2, Periodo 3 con una massa atomica di 24,3050. Il numero di elettroni in ciascuno dei gusci di magnesio è [2, 8, 2] e la sua configurazione elettronica è [Ne] 3s2. L'atomo di magnesio ha un raggio di 160 pm e un raggio di Van der Waals di 173 pm. Il magnesio fu scoperto da Joseph Black nel 1775 e isolato per la prima volta da Sir Humphrey Davy nel 1808. Il magnesio è l'ottavo elemento più abbondante nella crosta terrestre e il quarto elemento più comune nella terra nel suo insieme. Magnesio elementare Nella sua forma elementare, il magnesio ha un aspetto metallico grigio brillante ed è estremamente reattivo. Si trova in minerali come brucite, carnallite, dolomite, magnesite, olivina e talco. Commercialmente, il magnesio viene utilizzato principalmente nella creazione di leghe di alluminio-magnesio resistenti e leggere, che presentano numerosi vantaggi nelle applicazioni industriali. Il nome"Magnesio"proviene da un distretto greco della Tessaglia chiamato Magnesia.
Il fluoro è un elemento del blocco P, gruppo 17, periodo 2. La sua configurazione elettronica è [He]2s22p5. L'atomo di fluoro ha un raggio covalente di 64 pm e il suo raggio di Van der Waals è di 135 pm. Nella sua forma elementare, CAS 7782-41-4, il fluoro gassoso ha un aspetto giallo pallido. Il fluoro fu scoperto da André-Marie Ampère nel 1810. Fu isolato per la prima volta da Henri Moissan nel 1886.
Il fluoruro di magnesio è altamente insolubile in acqua (0,0076 g/100 mL) a 18°C [151]. Può essere agglomerato con acqua, pressato in pellet verdi, disidratato e sinterizzato ad alte temperature per produrre pellet porosi che possono essere utilizzati per intrappolare selettivamente il tecnezio. Il tecnezio intrappolato non può essere facilmente desorbito dal MgF2, richiedendo temperature superiori a 1000°C. Tuttavia, il tecnezio intrappolato può essere facilmente rimosso mediante lavaggio con acqua o acido nitrico diluito. Il fluoruro di magnesio può essere riutilizzato dopo una fase di essiccazione [152]. Il fluoruro di magnesio è stato utilizzato su larga scala per l'intrappolamento selettivo di fluoruri di tecnezio volatili e ossifluoruri di tecnezio mescolati con UF6 [22,152,153].
I rivestimenti contenenti fluoruro di magnesio (MgF2) sono stati preparati su metalli biodegradabili a base di Mg attraverso la conversione chimica che coinvolge l'acido fluoridrico (Chiu, Wong, Cheng e Man, 2007; Lin, Tan, Wan et al., 2013; Pereda et al. , 2010; Thomann et al., 2010; Yan et al., 2010) o MAO (Pan, Chen, Wang, & Lin, 2013; Pan, Chen, Wang, & Zhao, 2013; Seyfoori, Mirdamadi, Khavandi, & Raufi , 2012). Il fluoro (F) è un componente naturale nelle ossa e nei denti umani (Zheng, Wu, Ng, Wang e Lian, 2002). Un corretto rilascio di F non causerà danni agli organismi (Thomann et al., 2010). La risposta ossea al fluoruro è dose-dipendente: un rilascio a basso dosaggio di F faciliterà la formazione ossea; tuttavia, una dose elevata di esso causerà la formazione di osteoidi scarsamente mineralizzati (Ellingsen, 1995). Pertanto, MgF2 è un materiale di rivestimento accettabile,
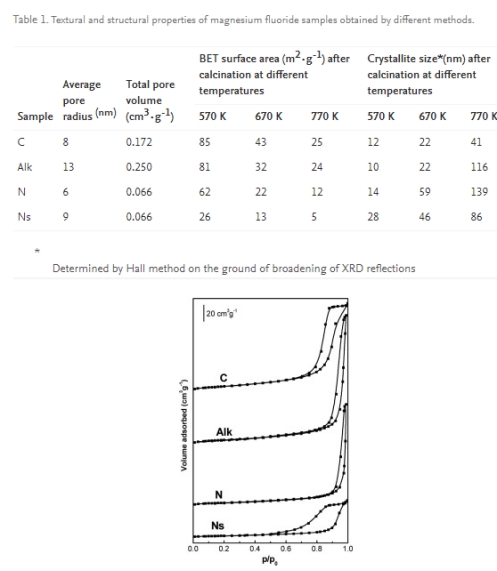
Il fluoruro di magnesio è stato preparato utilizzando quattro metodi diversi, tuttavia, il trattamento termico di tutti i campioni era identico e consisteva nella calcinazione a 670 K. Nonostante la stessa temperatura di calcinazione, i campioni di MgF2 differiscono notevolmente nella loro struttura porosa che si riflette nella forma del ciclo di isteresi in l'isoterma di adsorbimento di azoto a bassa temperatura, superficie specifica, dimensione dei pori e volume dei pori (Tabella 1; Figura 1). La superficie maggiore (43 mq·g-1) è stato ottenuto nel caso del campione di carbonato (C), mentre quello più piccolo (13 m2·g-1) nel caso di MgF2 sferico preparato da nitrato di magnesio (Ns). Le isoterme di adsorbimento-desorbimento di tutti i campioni sono di tipo IV, tuttavia differiscono nella forma dei loro cicli di isteresi. Questi ultimi appartengono al tipo H1 per i campioni C, Alk e N, che indica la presenza di pori cilindrici, mentre il ciclo di isteresi del campione Ns combina le caratteristiche dei cicli di isteresi dei tipi H1 e H2, riscontrabili in presenza di pori a collo stretto. La massima dimensione dei pori (r = 13 nm) e volume dei pori (0,250 cm3·g-1) sono stati trovati nel fluoruro di magnesio preparato da alcossido di magnesio (Alk). Il campione discusso è anche caratterizzato dalla stabilità termica più bassa come dedotto dal considerevole aumento delle dimensioni dei cristalliti e dalla drastica riduzione dell'area superficiale con l'aumento della temperatura di calcinazione (Tabella 1). La massima resistenza alla sinterizzazione e alla ricristallizzazione ad alte temperature è stata dimostrata dai campioni di carbonato (C) e nitrato-sferico (Ns).
Parte del contenuto di questo articolo proviene da Scienza diretta:https://www.sciencedirect.com
FOSHAN NANHAI SHUANGFU CHIMICA CO., LTD è una delle manifatture dimedio e altoqualitàFluoruro di magnesio,fornitura a lungo termine produzione e consegna di questo prodotto in tutto il mondo.
All'attenzione di:Nicole Huang (Responsabile vendite)
Aggiungere: Qishan Industry Park, Yanfeng Road, Shishan, distretto di Nanhai, città di Foshan, Cina.
Telefono:86 757 81108788
Mobile: 86 13928083637
E-posta: sales@df-chemicals.com




